iRhom2 regola il rilascio delle molecole MHC di classe I
Abstract
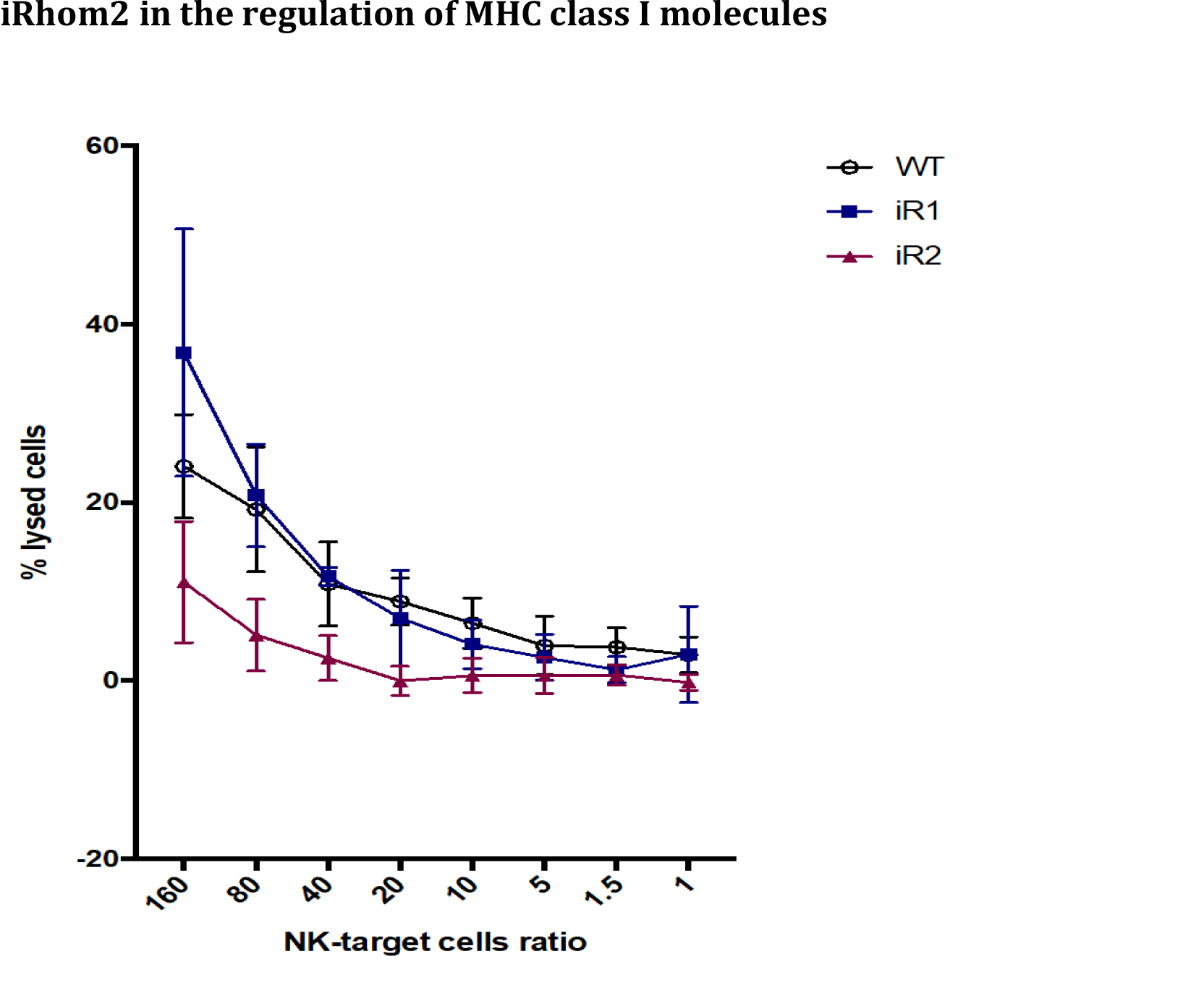
Il rilascio proteolitico di proteine transmembrana, il cosiddetto ectodomain shedding, è una modifica post-traduzionale che gioca un ruolo cruciale nella comunicazione cellulare e in altri processi biologici. Il termine “sheddasi” si riferisce alle proteasi ancorate alla membrana che effettuano lo “shedding” proteolitico. Tra queste, ADAM17 è la più investigata per il suo ruolo fondamentale nell’immunità. Infatti, ADAM17 venne identificata circa 30 anni fa come l’enzima responsabile per il rilascio del fattore di necrosi tumorale (TNF), una citochina pro-infiammatoria associata all’insorgenza di malattie autoimmuni come l’artrite o il morbo di Crohn. Da allora si è scoperto che ADAM17 rilascia oltre 80 proteine, regolando in questa maniera numerosi processi biologici, non solo nel sistema immunitario ma anche in altri tessuti. Per esempio, recentemente si è scoperto che ADAM17 processa l’enzima di conversione dell’angiotensina-2 (ACE2), che è anche il recettore per l’entrata del SARS-CoV-2, o TREM2, il più importante fattore di rischio genetico associato alla malattia di Alzheimer. È chiaro che identificare nuovi substrati di ADAM17 permetterebbe la scoperta di nuove funzioni di questo enzima, e potenzialmente nuovi target terapeutici. Per fare ciò, abbiamo messo a punto un nuovo metodo di proteomica quantitativa, secretome analysis of heparin-treated cells (Hep-sec) che permette l’identificazione di tutti quei substrati di ADAM17 che vengono internalizzati velocemente dopo lo shedding o che vengono sequestrati dalla matrice extracellulare. Questa procedura ci ha permesso di identificare le molecole del complesso maggiore di istocompatibilità di classe I (MHC-I) come un nuovo substrato di ADAM17. MHC-I hanno un ruolo cruciale nella risposta immunitaria ai virus e nella progressione tumorale, in quanto presentano gli antigeni virali e tumorali ai linfociti T citotossici e alle cellule natural killers (NKs). Inoltre, abbiamo scoperto che il regolatore di ADAM17 conosciuto come iRhom2, oltre a supportare la maturazione e l’attività dell’enzima, è coinvolto nella regolazione dei livelli di MHC di classe I. L’ablazione genetica di iRhom2 in macrofagi e fibroblasti murini rende queste cellule incapaci di rilasciare MHC I nel mezzo condizionato. Studiare le conseguenze funzionali di questo meccanismo di regolazione è il maggiore obiettivo per il 2022.
Impatto:
iRhom2 è un regolatore essenziale di ADAM17, una proteasi che, per la sua capacità di convertire il TNF da “proteina di membrana” a citochina solubile, gioca un ruolo chiave nelle risposte immunitarie. I nostri risultati mostrano che, oltre al TNF, iRhom2 regola lo shedding delle molecole MHC di classe I, proteine fondamentali nelle risposte immunitarie in quanto capaci di esporre gli antigeni peptidici per il riconoscimento e l’attivazione delle cellule immunitarie. È chiaro, quindi, come questa ricerca possa contribuire a incrementare la conoscenza scientifica sui meccanismi molecolari dell’immunità e, potenzialmente, sviluppare trattamenti terapeutici per malattie virali e tumori. Inoltre, la metodologia proteomica che abbiamo sviluppato per identificare MHC-I come substrato di ADAM17, potrebbe essere utilizzata per l’analisi proteomica di fattori di crescita, chemochine e altre proteine che solitamente legano la matrice extracellulare, e quindi non sono facili da identificare nel mezzo condizionato di cellule in coltura.
Pipeline
-
CLINICAL
NEED -
DISEASES
ANALYSIS - DISCOVERY
-
PRECLINICAL
VALIDATION -
PRECLINICAL
DEVELOPMENT -
CLINICAL
STUDIES
Principal Investigator
Contatto
Aree terapeutiche:
Prodotto:
Farmaci chimici e biologici
Collaborazioni:
- German Center for Neurodegenerative Diseases (DZNE), Monaco, Germania
- Weill Cornell Medicine Graduate School of Medical Sciences, New York, Stati Uniti
Finanziamenti:
Lorem ipsum dolor sit amet, consectetur adipiscing elit.
Quisque blandit nulla nec velit molestie cursus.
Vestibulum gravida purus nec nulla semper, non molestie augue tempor.
Scarica il pdf del progetto
